En una reacció química es formen uns productes a partir
d'uns reactius, però també es produeix un intercanvi d'energia entre el sistema
format per reactius i productes i el seu entorn. Aquest intercanvi d'energia
consisteix en la cessió o l'absorció de calor.
La raó cal buscar-la, un cop més, en el procés que passa a escala microscòpica. Es requereix una aportació energètica per trencar els enllaços en els reactius; per altra banda, la formació dels enllaços en els productes allibera una certa quantitat d'energia; la diferència entre les dues quantitats d'energia és l'energia intercanviada durant la reacció.
La raó cal buscar-la, un cop més, en el procés que passa a escala microscòpica. Es requereix una aportació energètica per trencar els enllaços en els reactius; per altra banda, la formació dels enllaços en els productes allibera una certa quantitat d'energia; la diferència entre les dues quantitats d'energia és l'energia intercanviada durant la reacció.
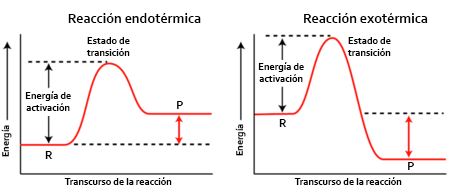
En el transcurs d'una reacció química té lloc un intercanvi d'energia en forma de calor entre el sistema i el medi. Si la reacció allibera calor es diu que és exotèrmica, si, per contra, absorbeix calor, es denomina endotèrmica.
La combustió és la reacció entre una substància (el combustible) i l'oxigen atmosfèric. La característica fonamental d'aquesta reacció és que és molt ràpida i desprèn gran quantitat de calor. De fet, l'interès d'aquest procés químic no està en els productes que es formen (diòxid de carboni i vapor d'aigua), sinó en l'energia alliberada, que pot aprofitar-se directament o ser transformada en altres tipus d'energia. Estudiarem aquesta reacció en la unitat següent.
Per representar els canvis energètics que acompanyen una reacció química, vam recórrer a un diagrama d'energia, en el qual representem l'energia al principi (reactius), durant i al final de la reacció (productes).
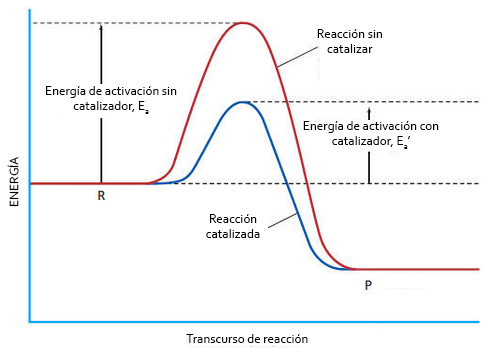
Si la reacció transcorre en presència d'un catalitzador, l'energia d'activació disminueix. Per tant, en el diagrama d'energia observaríem que l'energia màxima assolida durant el procés és menor.

Cap comentari:
Publica un comentari a l'entrada